Запитання «Розчинність твердих, рідких, газоподібних речовин у воді. Урок «Розчинення
Сьогодні ми поговоримо про речовину – воду!
А чи бачив хтось із вас воду?
Питання здалося вам безглуздим? Але він відноситься до абсолютно чистої води, в якій немає домішок. Якщо бути чесним і точним у відповіді, доведеться зізнатися, що таку воду ні я, ні ви поки не бачили. Саме тому на склянці з водою після напису «Н2О» стоїть знак питання. Значить у склянці не чиста вода, а що тоді?
У цій воді розчинені гази: N 2 , O 2 , CO 2 , Ar, солі з ґрунту, катіони заліза із водопровідних труб. Крім того, в ній зважено найдрібніші частинки пилу. Ось що ми називаємо чистою водою! Багато вчених працює над вирішенням тяжкої проблеми – отримати абсолютно чисту воду. Але поки що отримати таку ультрачисту воду не вдалося. Однак, ви можете заперечити, що є дистильована вода. До речі, що вона є?
Насправді ми отримуємо воду, коли стерилізуємо банки перед консервуванням. Перевертаємо банку догори дном, поміщаємо її над окропом. На денці банки з'являються крапельки, це дистильована вода. Але як тільки ми перевернемо банку, до неї заходять гази з повітря, і знову у банку – розчин. Тому грамотні господині намагаються одразу після стерилізації заповнити банки необхідним вмістом. Кажуть, що продукти у цьому випадку зберігатимуться довше. Можливо, вони мають рацію. Можете поекспериментувати! Саме тому, що вода здатна розчиняти у собі різні речовини, вчені не можуть досі отримати ідеально чисту воду у великих обсягах. А вона б у нагоді, наприклад, у медицині для приготування ліків.
До речі, перебуваючи у склянці, вода «розчиняє» скло. Тому чим товще скло, тим довше прослужать склянки. А що таке морська вода?
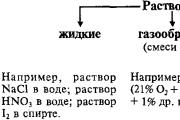
Це розчин, де міститься багато речовин. Наприклад, кухонна сіль. А як можна виділити кухонну сіль із морської води?
Випарюванням. До речі, саме так чинили наші предки. В Онєзі були солеварні, де з морської води випарювали сіль. Сіль продавали новгородським купцям, купували своїм нареченим та дружинам дорогі прикраси, шикарні тканини. Таких нарядів, як у непритомності, не було навіть у московських модниць. А лише завдяки знанням властивостей розчинів! Отже, сьогодні ми з вами говоримо про розчини та розчинність. Запишемо у зошиті визначення розчину.
Розчин – однорідна система, що складається з молекул розчинника та розчиненої речовини, між якими відбуваються фізичні та хімічні взаємодії.
Розглянемо схеми 1-2 і розберемо, які бувають розчини.
Якому з розчинів ви віддасте перевагу, готуючи суп? Чому?
Визначте де розбавлений розчин, де концентрований розчин мідного купоросу?
Якщо в певному обсязі розчину міститься мало розчиненої речовини, то такий розчин називають розведеним, якщо багато – концентрованим
.
Визначте де який розчин?
Не слід змішувати поняття «насичений» та «концентрований» розчин, «ненасичений» та «розведений» розчин.
Одні речовини добре розчиняються у воді, інші мало, а треті не розчиняються зовсім. Подивіться відео "Розчинність твердих речовин у воді"
Виконайте завдання у зошиті: Розподіліть запропоновані речовини -З 2 , H 2 , O 2 , H 2 SO 4 , Оцет, NaCl, Крейда, Іржа, Рослинна олія, Спиртв порожній стовпчик таблиці 1, використовуючи свій життєвий досвід.
Таблиця 1
|
Розчинене |
Приклади речовин |
|
|
Розчинні |
Малорозчинні |
|
|
Газ |
||
|
Рідина |
||
|
Тверда речовина |
||
А чи можете ви сказати про розчинність FeSO 4?
Як же бути?
Для того щоб визначити розчинність речовин у воді, ми будемо користуватися таблицею розчинності солей, кислот та основ у воді. Вона знаходиться у додатках до уроку.
У верхньому рядку таблиці – катіони, у лівому стовпці – аніони; шукаємо точку перетину, дивимося букву – це і є розчинність.
Визначимо розчинність солей: AgNO 3 , AgCl, CaSO 4 .
Розчинність збільшується із зростанням температури (бувають винятки). Ви чудово знаєте, що зручніше та швидше розчиняти цукор у гарячій, а не у холодній воді. Подивіться "Теплові явища при розчиненні"
Спробуйте самі, використовуючи таблицю, визначити розчинність речовин.
Завдання. Визначити розчинність наступних речовин: AgNO 3 , Fe(OH) 2 , Ag 2 SO 3 , Ca(OH) 2 , CaCO 3 , MgCO 3 , KOH.
ВИЗНАЧЕННЯ на тему «Розчини»
Розчин– однорідна система, що складається з молекул розчинника та розчиненої речовини, між якими відбуваються фізичні та хімічні взаємодії.
Насичений розчин - Це розчин, в якому ця речовина при цій температурі більше не розчиняється.
Ненасичений розчин - це розчин, у якому за даної температури речовина ще може розчинятися.
Суспензієюназивають суспензію, в якій дрібні частинки твердої речовини рівномірно розподілені між молекулами води.
Емульсієюназивають суспензію, в якій дрібні крапельки будь-якої рідини розподілені між молекулами іншої рідини.
Розведені розчини - Розчини з невеликим вмістом розчиненої речовини.
Концентровані розчини - Розчини з великим вмістом розчиненої речовини.
ДОДАТКОВО:
За співвідношенням переважання числа частинок, що переходять у розчин або видаляються з розчину, розрізняють розчини насичені, ненасичені та пересичені. За відносними кількостями розчиненої речовини та розчинника розчини поділяють на розведені та концентровані.
Розчин, у якому дана речовина за даної температури більше не розчиняється, тобто. розчин, що знаходиться в рівновазі з розчиняється речовиною, називають насиченим, а розчин, в якому ще можна розчинити додаткову кількість даної речовини, - ненасиченим.
Насичений розчин містить максимально можливу (для цих умов) кількість розчиненої речовини. Отже, насиченим розчином є такий розчин, що знаходиться в рівновазі з надлишком розчиненої речовини. Концентрація насиченого розчину (розчинність) для даної речовини за певних умов (температура, розчинник) - величина постійна.
Розчин, що містить розчиненої речовини більше, ніж його має бути в цих умовах насиченому розчині, називається пересиченим. Пересичені розчини є нестійкими, нерівноважними системами, в яких спостерігається мимовільний перехід у рівноважний стан. При цьому виділяється надлишок розчиненої речовини і розчин стає насиченим.
Насичений та ненасичений розчини не можна плутати з розбавленим та концентрованим. Розведені розчини- Розчини з невеликим вмістом розчиненої речовини; концентровані розчини- Розчини з великим вмістом розчиненої речовини. Необхідно підкреслити, що поняття розбавлений та концентрований розчини є відносними, що виражають лише співвідношення кількостей розчиненої речовини та розчинника у розчині.Увага! Адміністрація сайту сайт не несе відповідальності за зміст методичних розробок, а також за відповідність розробці ФГОС.
Автор - Севостьянова Людмила Миколаївна, учитель хімії вищої кваліфікаційної категорії муніципального автономного загальноосвітнього закладу середньої школи №3 р.п. Ілліногорськ, Володарського муніципального району Нижегородської області
Позначення предметного змісту проекту. Учні отримують уявлення про розчинення, як про фізико-хімічний процес, поняття гідратів і кристалогідратів, розчинності, кривих розчинності, як моделі залежності розчинення від температури, насичених, перенасичених і ненасичених розчинах. Роблять висновки про значення розчинів для природи та сільського господарства.
Методична розробка складена на основі програми основної загальної освіти з хімії, навчально-методичного комплексу О.С.. Габрієляна «Хімія. 8-11 класи (Робочі програми. Хімія8-11 класи: навчально-методичний посібник/уклад. Г.М. Пальдяєва. – 2 видавництва, стереотип. М.: Дрофа, 2013). Цей концентричний курс відповідає Федеральному державному освітньому стандарту основної загальної освіти, схвалений РАВ та РАН, має гриф «Рекомендовано» та включений до Федерального переліку підручників.
Відповідно до чинного Базового навчального плану, робоча програма для 8-го класу передбачає навчання хімії в обсязі 2 години на тиждень.
Розділ.Розчинення. Розчини. Властивості електролітів.
Тема.Розчинність. Розчинність речовин у воді.
Обгрунтування доцільності даного предметного змісту в організацію проектної/дослідницької діяльності учнів. Через організацію дослідницької діяльності сформувати уявлення про розчинення як про фізико-хімічний процес. На основі знань та умінь, здобутих у ході активного пошуку та самостійного вирішення проблеми, учні навчаються встановлювати міжпредметні та причинно-наслідкові зв'язки
Також цей проект, спрямований на сформування уявлення про фізико-хімічний процес розчинення, вивчення розчинності різних речовин від різних умов забезпечує розвиток сталого інтересу до хімії.
Назва проекту: «Розчини. Розчинність речовин у воді».
Опис проблемної ситуації, визначення проблеми та мети проектного модуля. Вчитель організує дії учнів щодо виявлення та формулювання проблеми, пропонуючи учням провести міні-дослідження «Приготування водних розчинів перманганату калію та сірчаної кислоти». Учні під час проведення дослідів зазначають, що у процесі розчинення речовин спостерігаються як ознаки фізичного, і ознаки хімічного явища.
Учні разом із учителем формулюють протиріччя.
Протиріччя:У процесі розчинення можна спостерігати з одного боку ознаки фізичних явищ, з іншого – хімічних явищ.
Проблема:Процес «розчинення» – це процес хімічний чи фізичний? Чи можна проводити цей процес?
Опис проектного продукту/результату з критеріями оцінки.
Мета проектного модуля:довести сутність процесу розчинення та пояснити залежність розчинності від різних факторів через створення ментальної карти «Розчинність речовин у воді».
Проектний продукт:ментальна карта "Розчинність речовин у воді".
Ментальна карта є систематизованим і представленим у наочній формі матеріалом. У центрі записується тема проекту «Розчинність речовин». Учням пропонується на основі проведених міні-досліджень сформулювати висновки та творчо оформити їх у декілька блоків:
Кожен окремий проектний продукт пари оцінюється за такими критеріями.
- Естетичність оформлення
- Структурність оформлення
- Логічність оформлення
- Наочність
- 1 бал – представлений частково
Оцінка «5» – 15-14 балів
Оцінка «4» – 13-11 балів
Оцінка «3» - 10-7 балів
Оцінка «2» -менше 7 балів
Визначення загального обсягу урочного годинника, необхідних для реалізації проекту, та його розподіл за етапами проектної діяльності учнів із зазначенням дій педагога та учнів.
Проектний модуль включає 3 уроки (3 години проектного модуля реалізуються за рахунок 1 години, що відводиться на вивчення теми «Розчини. Розчинність речовин» та 2 години за рахунок резервного часу):
Фази ПД |
Етапи ПД |
Поурочне планування |
Проектування |
Актуалізація |
1 урок Домашнє завдання |
Проблематизація |
||
Цілепокладання |
||
Планування |
||
Концептуалізація Моделювання |
||
Реалізація |
Розробка критеріальної бази |
2 урок Домашнє завдання |
Реалізація проектного продукту |
||
Подання проектного продукту Оцінка Рефлексія |
Подання |
3 урок Домашнє завдання |
Захист проекту |
||
Рефлексія |
||
Діагностика рівня сформованості проектних процесів |
Поетапний опис проектного модуля, дій учнів, дій педагога.
Етапи проектної діяльності |
Діяльність вчителя |
Діяльність учнів |
Кошти |
Результат |
||||||||
1-й урок (підготовчий та проектувальний етапи): актуалізація – проблематизація – цілепокладання – планування дій-концептуалізація. |
||||||||||||
Актуалізація наявної системи: предметних знань та способів діяльності, метапредметних способів діяльності, цінностей та смислів, пов'язаних із змістом модуля та самим процесом пізнання. |
Організовує повторення правил техніки безпеки та поведінки у кабінеті хімії. Організує фронтальне виконання завдань, спрямованих на засвоєння теми «Фізичні та хімічні явища» Задає питання учням: "Як відрізнити хімічні явища від фізичних?", "Які ознаки хімічних реакцій?" |
Відповідають на запитання. Перегляд у режимі «без звуку» флеш-ролика «Ознаки хімічних реакцій». Вказують ознаки хімічних реакцій, коментують свою відповідь. Міркують і роблять висновок про те, що хімічні явища характеризуються утворенням нових речовин, з новими ознаками. Ознаками хімічних реакцій може бути: поява запаху (виділення газу), утворення осаду, зміна кольору. |
Мультимедійний комплекс та інтерактивна дошка. Матеріал Єдиної колекції ЦОР |
Виявлено кордон «знання-незнання» |
||||||||
Проблематизація- Визначення проблеми проекту та причин, що призводить до появи проблеми. |
Організовує дії учнів щодо виявлення та формулювання протиріччя та проблеми. Проведення міні-дослідження: «Приготування водних розчинів перманганату калію та сірчаної кислоти» |
Учні, дотримуючись правил техніки безпеки, виконують міні-дослідження №1: , описують свої спостереження, заповнюють таблицю. Розчинення
Проблема: До яких явищ відноситься процес розчинення, фізичним або хімічним, як можна описати процес розчинення речовин? |
Алгоритм виконання міні-дослідження №1 Додаток №1 Обладнання та реактиви: : KМnО 4 , Н 2 SО 4 (конц.), безводний СuSО 4 вода, пробірки, штатив. |
Сформульовано проблему |
||||||||
Цілепокладання- Визначення мети та завдань проекту. |
На основі сформульованої проблеми створює умови для формулювання мети та визначення майбутнього проектного продукту |
Формулюють мету проекту за допомогою вчителя: описати модель процесу розчинення, визначити фактори, що впливають на процес розчинення, провести класифікацію розчинів, вказати значення та застосування розчинів. За допомогою вчителя визначають блоки ментальної карти: 1 блок: «Модель процесу розчинення» 2 блок: "Залежність процесу розчинення від різних факторів" 3 блок: "Класифікація розчинів" 4 блок: «Значення та застосування розчинів» |
Сформульовано мету загального проектного продукту. |
|||||||||
Планування дій |
Створює умови для формування проектних груп та розподіл обов'язків усередині груп щодо виконання проектних завдань
|
Клас ділиться на 5 груп по 4-5 осіб. Кожна група обирає керівника. Разом із учителем промовляють спільний план дій.
|
Сформовано групи учнів до виконання проекту. Розроблено план подальшої роботи |
|||||||||
Організовує дії учнів до роботи у групах. Надає допомогу у розподілі обов'язків усередині групи Пропонує роботу у групах за єдиними завданнями: прочитати текст підручника с.186-188, оформити схему-модель процесу розчинення. Направляє групи на виконання практичного міні-дослідження №2 «Спостереження впливу природи розчиненої речовини на процес розчинення» Спрямовує групи виконання практичного міні-дослідження №3 «Спостереження впливу природи розчинника на процес розчинення речовин» Спрямовує групи виконання практичного міні-дослідження №4 «Спостереження впливу температури на розчинність речовин.». |
Складають схему-модель «Розчин як фізико-хімічний процес». Кожен учень усередині групи самостійно читає текст. 1 учень: розглядає історію вивчення цього питання. 2 учень: виділяє прихильників фізичної теорії розчинів 3 учень: виділяє прихильників хімічної теорії розчинів 4 учень: описують сучасні уявлення, складають схему-модель РОЗЧИН = Н2О + Р.В. + ГІДРАТИ(продукти взаємодії Н2О розчиненими речовинами). 5 учень планує та оформляє блок 1 ментальної карти. Учні, дотримуючись правил техніки безпеки, виконують міні-дослідження №2 «Спостереження впливу природи розчиненої речовини на процес розчинення» за запропонованим алгоритмом, формулюють висновок. Формулюють висновки: Природа речовини, що розчиняється, впливає на процес розчинення. Розчинність речовини залежить від природи самої речовини. Учні, дотримуючись правил техніки безпеки, виконують міні-дослідження №3 «Спостереження впливу природи розчинника на процес розчинення речовин» за запропонованим алгоритмом, формулюють висновок. Формулюють висновки: Природа розчинника впливає процес розчинника. Розчинність речовини залежить від природи самої речовини. Учні, дотримуючись правил техніки безпеки, виконують міні-дослідження №4 «Спостереження впливу температури на розчинність речовин». За запропонованим алгоритмом формулюють висновок. Формулюють висновки: Зі збільшенням температури розчинність речовини збільшується. Можлива побудова моделі розчинності залежно від температури. |
Проектні завдання "Мозковий штурм" Алгоритм міні-дослідження №2 Додаток 2 Обладнання та реактиви: пронумеровані пробірки з речовинами: №1 Хлорид кальцію №2 гідроксид кальцію №3 карбонат кальцію, вода. Алгоритм міні-дослідження №3 Додаток 3 Обладнання та реактиви: Дві пронумеровані пробірки №1 і №2 з декількома кристалами йоду, спирт, вода. Алгоритм міні-дослідження №4 Додаток 4 |
Створено проміжні продукти: схема – модель процесу розчинення. Сформульовані фактори, що впливають на розчинність речовин:
|
|||||||||
Концептуалізація та моделювання –створення образу об'єкта проектування. |
Організовує дії учнів щодо створення образу проектного продукту. Консультує учнів щодо створення проектного продукту. |
Учні у групах обговорюють, яким буде підсумковий модуль, аргументують свою думку, вислуховують учнів своєї групи, беруть участь у обговоренні макета. . |
Мозковий штурм |
Створено образ (модель) проектного продукту – ментальної карти «Розчинність речовин» |
||||||||
Організує роботу з розподілу блоків усередині групи, організує роботу із заповнення табеля обліку роботи над проектом |
Вибирають блок для заповнення, домовляються один з одним, пропонують взаємодопомогу у розподілі та оформленні блоків. Оцінюють свою власну роботу та роботу однокласників |
Табель обліку роботи над проектом |
Розподілено всі блоки всередині кожної групи, оцінено роботу за урок. |
|||||||||
Д/з:вивчити параграф 34, виконати завдання у робочому зошиті. Підібрати ілюстрації для блоків до ментальної карти, що ілюструють класифікацію та застосування розчинів. |
||||||||||||
2-й урок (етап реалізації): розв'язання конкретно-практичних завдань. Створення проектного продукту. |
||||||||||||
Розробка критеріальної бази |
Організує роботу щодо створення критеріїв проекту |
Пропонують варіанти критеріїв оцінки проектного продукту:
За кожен критерій від 0 до 3 балів:
Оцінка «5» – 15-14 балів Оцінка «4» – 13-11 балів Оцінка «3» - 10-7 балів Оцінка «2» -менше 7 балів |
Прийом «Дерево думок» |
Розроблено критерії оцінки проекту |
||||||||
Вирішення конкретно-практичних завдань та створення освітніх продуктів(Створення проектного продукту) |
Створює умови реалізації проектного продукту. Організується виконання проектного завдання, розглядається вимоги щодо складання ментальної карти, вимоги до структурування знайденої інформації Кожна група отримує проектне завдання та алгоритм його виконання, здійснює консультаційну допомогу у створенні проектного продукту. |
Учні відповідно до розподілених обов'язків визначають образ конкретно-практичного завдання. Це буде ментальна карта, де буде структурована інформація на тему «Розчинність речовин. Розчини». У центрі буде позначено тему. Навколо розташовані 4 блоки. Інформація має бути подана у вигляді схем, малюнків, асоціацій. Учні розподіляють обов'язки групи: 1 учень: відповідальний за блок №1, командир групи 2 учень: відповідальний за блок №2, відстеження часу; 3 учень: відповідальний за блок №3, 4 учень: відповідальний за блок №4 5 учень: загальне оформлення роботи, відповідальний за оцінювання виконаної роботи. Виконання завдань спільно, але під контролем відповідального:
|
Папір, фломастери, ножиці, принтер |
Виконано проектні завдання. Створено проектний напівпродукт. |
||||||||
Д/з: повторити параграф 34. Доопрацювати створений проектний напівпродукт, підготувати виступ групи. |
||||||||||||
3-й урок «Презентація одержаного проектного продукту. Оцінка якості продукту та рефлексія дій у проекті його творців. |
||||||||||||
Презентація одержаного проектного продукту. |
Створює умови презентації проектного продукту |
Презентують створені проектні продукти – ментальну карту, зібрану із 4-х блоків. |
Демонстрація карти «Розчинність. Розчинені речовини». |
|||||||||
Оцінка якості проектного продукту та рефлексія дій у проекті його творців. |
Організовує узагальнення знань та виконаних дій. Пропонує співвіднести завдання та результати створення проекту, оцінити правильність вибору методу проекту. Узагальнює здобуті знання, виконані дії. Використовує критерії оцінки результатів. Оцінює отримані знання та освоєні дії відповідно до критеріїв. Здійснює контроль знань на тему «Розчинення. Розчинність речовин». |
Групи виходять захищати власний продукт. Оцінюють свою роботу у групі з реалізації проектної діяльності, роботу однокласників; а також оцінюють проекти. Заперечують чи погоджуються з оцінкою своїх робіт. Аналізують допущені недоліки. Вносять пропозиції до алгоритму виконання однотипних завдань. Оцінюють проектну діяльність відповідно до критеріїв оціночного листа. |
Оціночний лист проектної діяльності. Додаток №5 Оціночний лист проектного продукту Додаток №6 Завдання "Встав пропущене слово" за варіантами. |
Виставлено оцінки. Вказані помилки. Проведено рефлексію. Контроль знань. |
||||||||
Д/з:виконати завдання підручника с.192. Підготувати повідомлення про розчини, що використовуються в медицині – 1 ряд, у с/г – 2 ряд, у побуті – 3 ряд. |
||||||||||||
Опис проміжних проектних продуктів та опис домашніх завдань, що використовуються (дидактичне забезпечення проектного модуля).
На першому уроці вчитель перевіряє рівень засвоєння раніше вивченої теми, пропонує усно виконати завдання на актуалізацію знань - Перегляд у режимі «без звуку» флеш-ролика «Ознаки хімічних реакцій»
За підсумками роботи на першому уроці учні отримують проміжні продукти: звіти з міні-досліджень №1 «Спостереження процесів розчинення перманганату калію, концентрованої сірчаної кислоти та безводного сульфату міді»», №2 Спостереження впливу природи розчиненої речовини на процес розчинення», №3 « Спостереження впливу природи розчинника на процес розчинення» №4 «Спостереження впливу температури на процес розчинення»
Додому учні отримують таке завдання: вивчити параграф 34, виконати завдання у робочому зошит частина I тема 34 з допомогою інтернет - джерела підібрати ілюстрації на теми «Значення і застосування розчинів», «Класифікація розчинів».
На другому уроці учні розробляють проектний продукт відповідно до проектних завдань. Наприкінці уроку кожна група оформляє ментальну карту. Після другого уроку учні отримують домашнє завдання: доопрацювати проектний напівпродукт і підготувати у ньому міні-виступ, включаючи підготовку до проекту та її реалізацію.
Після третього уроку учні отримують домашнє завдання: підготувати повідомлення про застосування розчинів у побуті, с/г чи медицині.
Розчини- гомогенні (однорідні) системи змінного складу, які містять два або декілька компонентів.

Найбільш поширені рідкі розчини. Вони складаються з розчинника (рідини) та розчинених речовин (газоподібних, рідких, твердих):

Рідкі розчини можуть бути водні та неводні. Водні розчини- це розчини, у яких розчинником є вода. Неводні розчини- це розчини, в яких розчинниками є інші рідини ( , ефір тощо). Насправді частіше використовуються водні розчини.
Розчинення речовин
Розчинення- Складний фізико-хімічний процес. Руйнування структури речовини, що розчиняється, і розподіл її частинок між молекулами розчинника - це фізичний процес. Одночасно відбувається взаємодія молекул розчинника із частинками розчиненої речовини, тобто. Хімічний процес. Внаслідок цієї взаємодії утворюються сольвати.
Сольвати- продукти змінного складу, що утворюються за умови хімічної взаємодії частинок розчиненої речовини з молекулами розчинника.
Якщо розчинником є вода, то сольвати, що утворюються, називаються гідратами. Процес утворення сольватів називається сольватацією. Процес утворення гідратів називається гідратацією. Гідрати деяких речовин можна виділити у кристалічному вигляді при випаровуванні розчинів. Наприклад:

Що є і як утворюється кристалічна речовина синього кольору? При розчиненні у воді сульфату міді (II) відбувається його дисоціація на іони: 
Іони, що утворюються, взаємодіють з молекулами води: 
При випаровуванні розчину утворюється кристалогідрат сульфату міді (II) - CuSО 4 5Н 2 Про.
Кристалічні речовини, що містять молекули води, називаються кристалогідратами. Вода, що входить до їх складу, називається кристалізаційною водою. Приклади кристалогідратів:

Вперше ідею про хімічний характер процесу розчинення висловив Д. І. Менделєєв у розробленій ним хімічної (гідратної) теорії розчинів(1887). Доказом фізико-хімічного характеру процесу розчинення є теплові ефекти при розчиненні, тобто виділення чи поглинання теплоти.
Тепловий ефект розчинення дорівнює сумі теплових ефектів фізичного та хімічного процесів. Фізичний процес протікає із поглинанням теплоти, хімічний – із виділенням.
Якщо в результаті гідратації (сольватації) виділяється більше теплоти, ніж поглинається при руйнуванні структури речовини, то розчинення - екзотермічний процес. Виділення теплоти спостерігається, наприклад, при розчиненні у воді таких речовин, як AgNО 3 , ZnSО 4 та ін.
Якщо руйнування структури речовини необхідно більше теплоти, ніж її утворюється при гідратації, то розчинення - ендотермічний процес. Це відбувається, наприклад, при розчиненні у воді NaNО 3 KCl, K 2 SO 4 KNO 2 NH 4 Cl та ін.
Розчинність речовин
Ми знаємо, що одні речовини добре розчиняються, інші – погано. При розчиненні речовин утворюються насичені та ненасичені розчини.
Насичений розчин- це розчин, який містить максимальну кількість речовини, що розчиняється при даній температурі.
Ненасичений розчин- це розчин, який містить менше речовини, що розчиняється, ніж насичений при даній температурі.
Кількісною характеристикою розчинності є коефіцієнт розчинності. p align="justify"> Коефіцієнт розчинності показує, яка максимальна маса речовини може розчинитися в 1000 мл розчинника при даній температурі.
Розчинність виражають у грамах на літр (г/л).
За розчинністю у воді речовини ділять на 3 групи: 
Таблиця розчинності та у воді: 
Розчинність речовин залежить від природи розчинника, природи розчиненої речовини, температури, тиску (для газів). Розчинність газів у разі підвищення температури зменшується, у разі підвищення тиску - збільшується.
Залежність розчинності твердих речовин від температури показують криві розчинності. Розчинність багатьох твердих речовин збільшується у разі підвищення температури. 
По кривим розчинності можна визначити: 1) коефіцієнт розчинності речовин за різних температур; 2) масу розчиненої речовини, яка випадає в осад при охолодженні розчину від t 1 o C до t 2 o C.
Процес виділення речовини шляхом випаровування або охолодження її насиченого розчину називається перекристалізацією. Перекристалізація використовується для очищення речовин.
Розчин – це гомогенна система, що складається з двох або більше речовин, зміст яких можна змінювати у певних межах без порушення однорідності.
Воднірозчини складаються з води(розчинника) та розчиненої речовини.Стан речовин у водному розчині при необхідності позначається нижнім індексом (р), наприклад KNO 3 в розчині - KNO 3(p) .
Розчини, що містять малу кількість розчиненої речовини, часто називають розведеними,а розчини з високим вмістом розчиненої речовини – концентрованими.Розчин, в якому можливе подальше розчинення речовини, називається ненасиченим,а розчин, в якому речовина перестає розчинятися за цих умов, – насиченим.Останній розчин завжди знаходиться в контакті (в гетерогенній рівновазі) з нерозчинним речовиною (один кристал або більше).
В особливих умовах, наприклад, при обережному (без перемішування) охолодженні гарячого ненасиченого розчину твердогоречовини, що може утворитися пересиченийрозчин. При введенні кристала речовини такий розчин поділяється на насичений розчин та осад речовини.
Відповідно до хімічною теорією розчинівД. І. Менделєєва розчинення речовини у воді супроводжується, по-перше, руйнуваннямхімічних зв'язків між молекулами (міжмолекулярні зв'язки в ковалентних речовинах) або між іонами (в іонних речовинах), і, таким чином, частинки речовини поєднуються з водою (у якій також руйнується частина водневих зв'язків між молекулами). Розрив хімічних зв'язків відбувається за рахунок теплової енергії руху молекул води, при цьому відбувається витратаенергії у вигляді теплоти.
По-друге, потрапивши у воду, частинки (молекули чи іони) речовини піддаються гідратації.В результаті утворюються гідрати– сполуки невизначеного складу між частинками речовини та молекулами води (внутрішній склад самих частинок речовини при розчиненні не змінюється). Такий процес супроводжується виділенняменергії у формі теплоти за рахунок утворення нових хімічних зв'язків у гідратах
Загалом розчин або охолоджується(якщо витрата теплоти перевищує її виділення), або нагрівається (інакше); іноді – за рівності витрати теплоти та її виділення – температура розчину залишається незмінною.
Багато гідратів виявляються настільки стійкими, що не руйнуються і при повному випаровуванні розчину. Так, відомі тверді кристалогідрати солей CuSO 4 5Н 2 O, Na 2 CO 3 10Н 2 O, KAl(SO 4) 2 12Н 2 O та ін.
Вміст речовини в насиченому розчині при Т= const кількісно характеризує розчинністьцієї речовини. Зазвичай розчинність виражається масою розчиненої речовини, що припадає на 100 г води, наприклад, 65,2 г КBr/100 г Н 2 O при 20 °C. Отже, якщо 70 г твердого броміду калію ввести в 100 г води при 20 °C, 65,2 г солі перейде в розчин (який буде насиченим), а 4,8 г твердого КBr (надлишок) залишиться на дні склянки.
Слід запам'ятати, що вміст розчиненої речовини в насиченомурозчині одно, в ненасиченомурозчині меншеі в пересиченомурозчині більшейого розчинність при даній температурі. Так, розчин, приготований при 20 °C зі 100 г води та сульфату натрію Na 2 SO 4 (розчинність 19,2 г/100 г Н 2 O), при вмісті
15,7 г солі – ненасичений;
19.2 г солі – насичений;
2O.3 г солі – пересичений.
Розчинність твердих речовин (табл. 14) зазвичай збільшується зі зростанням температури (КBr, NaCl), і лише деяких речовин (CaSO 4 , Li 2 CO 3) спостерігається зворотне.
Розчинність газів у разі підвищення температури падає, а в разі підвищення тиску зростає; наприклад, при тиску 1 атм розчинність аміаку становить 52,6 (20 °C) і 15,4 г/100 г Н 2 O (80 °C), а при 20 °C і 9 атм вона дорівнює 93,5 г/100 р Н 2 O.
Відповідно до значень розчинності розрізняють речовини:
– добре розчинні,маса яких у насиченому розчині можна порівняти з масою води (наприклад, КBr – при 20 °C розчинність 65,2 г/100 г Н 2 O; 4,6 М розчин), вони утворюють насичені розчини з молярністю більш ніж 0,1 М;
– малорозчинні,маса яких у насиченому розчині значно менша за масу води (наприклад, CaSO 4 – при 20 °C розчинність 0,206 г/100 г Н 2 O; 0,015М розчин), вони утворюють насичені розчини з молярністю 0,1–0,001М;
– практично нерозчинні,маса яких у насиченому розчині зневажливо мала порівняно з масою розчинника (наприклад, AgCl – при 20 °C розчинність 0,00019 г на 100 г Н 2 O; 0,0000134М розчин), вони утворюють насичені розчини з молярністю менш ніж 0,001М.
За довідковими даними складено таблиця розчинностіпоширених кислот, основ і солей (табл. 15), в якій зазначений тип розчинності, зазначені речовини, не відомі науці (не отримані) або повністю розкладаються водою.
Розчинність- Це здатність речовин розчинятися у воді. Одні речовини дуже добре розчиняються у воді, деякі навіть у необмежених кількостях. Інші – лише у невеликих кількостях, а треті – взагалі майже не розчиняються. Тому речовини ділять на розчинні, малорозчинні та практично нерозчинні.
До розчинних належать такі речовини, які у 100 г води розчиняються у кількості більше 1 г (NaCl, цукор, HCl, KNO 3). Малорозчинні речовини розчиняються у кількості від 0,01 г до 1 г у 100 г води (Ca(OH) 2 , CaSO 4). Практично нерозчинні речовини не можуть розчинитись у 100 г води у кількості більше 0,01 г (метали, CaCO 3 , BaSO 4).
При протіканні хімічних реакцій у водних розчинах можуть утворюватися нерозчинні речовини, які випадають в осад або перебувають у завислому стані, роблячи розчин каламутним.
Існує таблиця розчинності у воді кислот, основ і солей, де відображено, чи є сполука розчинною. Всі солі калію та натрію, а також всі нітрати (солі азотної кислоти) добре розчиняються у воді. З сульфатів (солей сірчаної кислоти) малорозчинний сульфат кальцію, нерозчинні сульфати барію та свинцю. Хлорид свинцю малорозчинний, а хлорид срібла нерозчинний.
Якщо в клітинах таблиці розчинності стоїть рисочка, це означає, що з'єднання реагує з водою, у результаті утворюються інші речовини, тобто з'єднання у воді не існує (наприклад, карбонат алюмінію).
Усі тверді речовини, навіть добре розчинні у питній воді, розчиняються лише певних кількостях. Розчинність речовин виражають числом, яке показує найбільшу масу речовини, яка може розчинитись у 100 г води за певних умов (зазвичай мається на увазі температура). Так, при 20 °C у воді розчиняється 36 г кухонної солі (хлориду натрію NaCl), більше 200 г цукру.
З іншого боку, взагалі нерозчинних речовин немає. Будь-яка практично нерозчинна речовина хоча б у дуже незначній кількості, але розчиняється у воді. Наприклад, крейда розчиняється у 100 г води при кімнатній температурі у кількості 0,007 г.
Більшість речовин із підвищенням температури краще розчиняються у воді. Однак NaCl майже однаково розчинний за будь-якої температури, а Ca(OH)2 (вапно) краще розчиняється при нижчій температурі. На основі залежності розчинності речовин від температури будують криві розчинності.
Якщо в розчині за даної температури ще можна розчинити якусь кількість речовини, то такий розчин називають ненасиченим. Якщо ж досягнуто болю розчинності, і більше речовини розчинити не можна, то кажуть, що розчин насичений.
Коли охолоджують насичений розчин, розчинність речовини знижується, і, отже, вона починає випадати в осад. Часто речовина виділяється як кристалів. Для різних солей кристали мають форму. Так кристали кухонної солі мають кубічну форму, у калійної селітри вони схожі голки.